▊▊ 摘要
糖基化是影响治疗性糖蛋白稳定性、溶解性和免疫原性的关键质量属性。唾液酸作为聚糖的末端单糖,在决定糖蛋白的循环半衰期和生物活性方面发挥着重要作用。唾液酸含量通常影响治疗性糖蛋白的许多生化特性,唾液酸含量直接影响更具体的性质,如电荷分布、循环半衰期和生物活性。而在CHO细胞培养过程中通常会观察到蛋白质唾液酸化的不良损失,唾液酸降解是根本原因之一。本文研究了Fc融合蛋白生产过程中细胞外唾液酸酶对唾液酸的降解。

本文研究了可能影响唾液酸酶作用的潜在因素,发现pH超过7.05对CCS中唾液酸的降解有很强的抑制作用。并在具有不同pH控制的生物反应器中进一步验证了该结果,证明通过更高的pH控制可以缓解抗体中唾液酸的水解。本研究提供了一种简单有效的方法抑制唾液酸水解,并提高了对CHO工艺控制和产物唾液酸化之间关系的理解。
▊▊ 实验设计
将Fed-Batch培养(摇瓶)结束时的细胞培养液离心获得CCS,并将其分成30 ml等分试样。实验组使用细胞培养后期的培养条件(pH为6.75,温度为29 °C),直接孵育CCS;对照组通过将纯化的Fc融合蛋白加入新鲜培养基中,最终蛋白浓度接近1200 mg/L(与CCS组的浓度水平相同)。对于唾液酸和金属离子抑制研究:将游离NANA和两种氧化还原活性金属离子Cu2+和Co2+添加到CCS中;对于pH梯度的条件设定,加入NaHCO3或HCl将pH调节至6.75、6.90、7.05或7.20;对于温度梯度的条件设定,CCS在4个CO2培养箱中培养,温度控制在29 °C、32 °C、35 °C或37 °C,其他参数与细胞培养条件相同。将CCS过滤到无菌细胞培养管中,并在CO2培养箱中孵育(Cell free实验)。所有的培养箱都用5%CO2填充,以保持CCS的pH值。每天从CCS中取样,立即检测pH值,并在纯化后测定唾液酸含量和N-聚糖糖型分布。
结果显示唾液酸含量随着孵育时间的延长而逐渐降低,在第6天达到其原始水平的87.54±0.53%,并且在剩余的孵育时间内不再变化(图1)。当Fc融合蛋白在新鲜培养基中孵育时,唾液酸含量没有随时间变化。
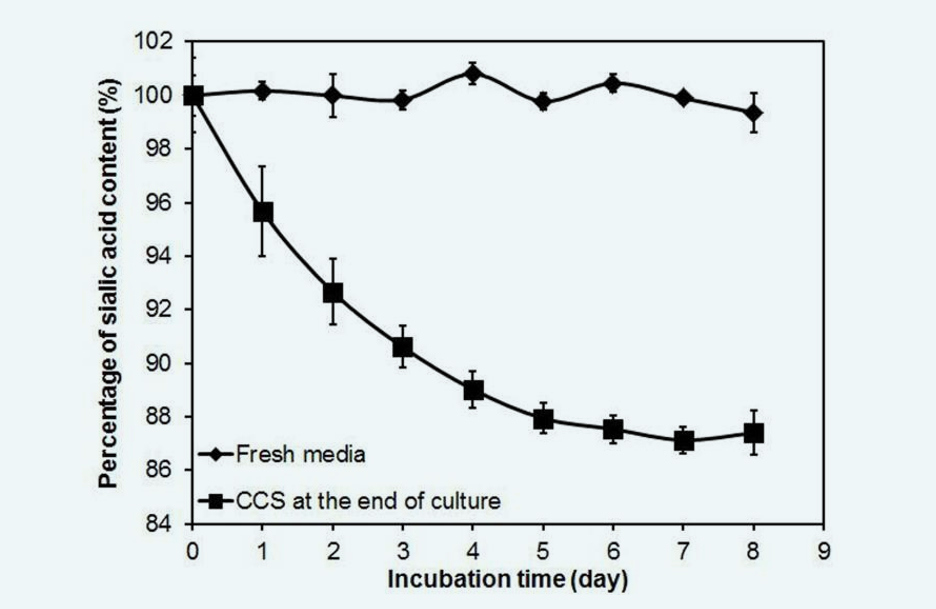
Fig. 1. Time course of sialic acid content in the Fc-fusion protein during cell free incubation (n=3). Data were normalized to the initial sialic acid content in the cell free experiment.
通过NP-HPLC分析Fc融合蛋白的N-聚糖组成[1]。如图2所示,Fc融合蛋白由主要典型的双触角复合物N-聚糖和极少数的三触角及四触角唾液酸化聚糖组成(不到总百分比的2%)。将双触角复合物N-聚糖分离为10个主要结构。图3显示了在Cell free培养过程中这些N-聚糖结构的变化。发现单唾液酸化(A1和A1F)和二唾液酸化N-聚糖(A2和A2F)的百分比显著降低。相应地,去唾液酸化糖型(G2和G2F)的百分比增加。除了唾液酸化外,Fc融合蛋白的半乳糖基化、岩藻糖基化和其他N-聚糖种类在Cell free孵育期间保持不变。这些结果表明,在细胞培养过程中,聚糖上的其他单糖不受CCS中培养基成分或相关糖苷酶的影响。因此,蛋白中唾液酸被CCS中的细胞外唾液酸酶水解。
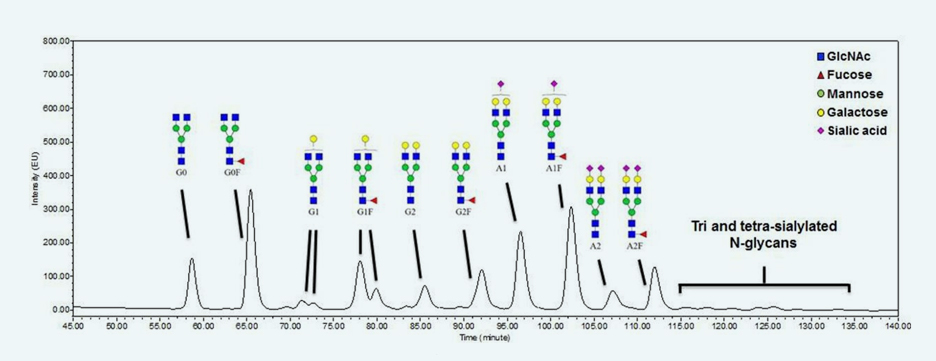
Fig. 2. The NP-HPLC N-glycan profile of the Fc-fusion protein.
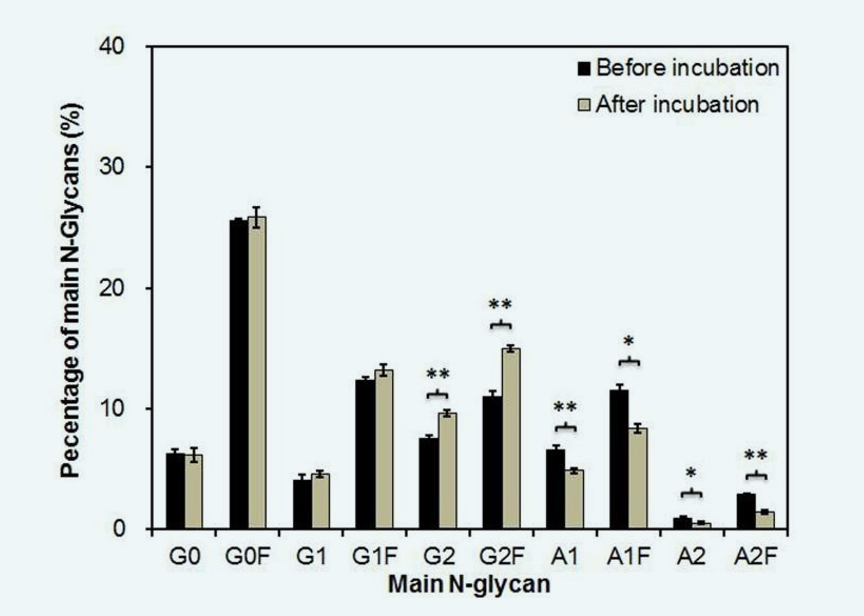
Fig. 3. The change in the main N-glycan distribution of the Fc-fusion protein after cell free incubation, *p<0.05, **p<0.01 relative to the initial status before incubation (n=3).

▊▊ 常见抑制因子对胞外唾液酸降解的影响
游离唾液酸
金属离子
氧化剂可能使细胞外CHO细胞唾液酸酶不稳定[2]。二价金属离子Cu2+和Co2+是氧化还原活性和潜在的唾液酸酶抑制剂,也被添加到CCS中,以研究它们对唾液酸降解的抑制作用。在细胞培养环境中,Cu2+和Co2+分别在1 mM和2.5 mM以上可以完全抑制细胞外唾液酸酶活性(图4A),相比之下,在没有额外金属离子的对照实验中,唾液酸降解率为11.77±0.64%(在培养基中为0.48μM Cu2+和无Co2+)。同时,至少需要0.2mM Cu2+和0.5mM Co2+来减少CCS中的唾液酸降解,以使唾液酸含量分别下降7.39±0.99%和8.69±0.58%。
据报道,Fc融合蛋白的错误折叠形式在培养过程中表达,并导致最终蛋白产物的生物活性较低[3-4]。在该研究中的Fc融合蛋白生产过程中也发现了错误折叠的蛋白质部分(35-40%)。尽管Cu2+和Co2+在抑制Fc融合蛋白的唾液酸降解方面是有效的,但孵育后,错误折叠的蛋白质组分的比例从33.83±0.44%(未添加)显著增加到36.45±0.46%(0.2mM Cu2+)和39.96±0.88%(1.0mM Cu2+)(图4B),而CCS对照组和Co2+添加组没有变化。除了蛋白质结构的变化外,Fc融合蛋白在与Co2+孵育后的颜色变红(图4C),表明可能形成了Co2+-蛋白复合物。这些发现表明,当Cu2+和Co2+用于抑制细胞外唾液酸降解时,它们改变了Fc融合蛋白的结构和颜色。
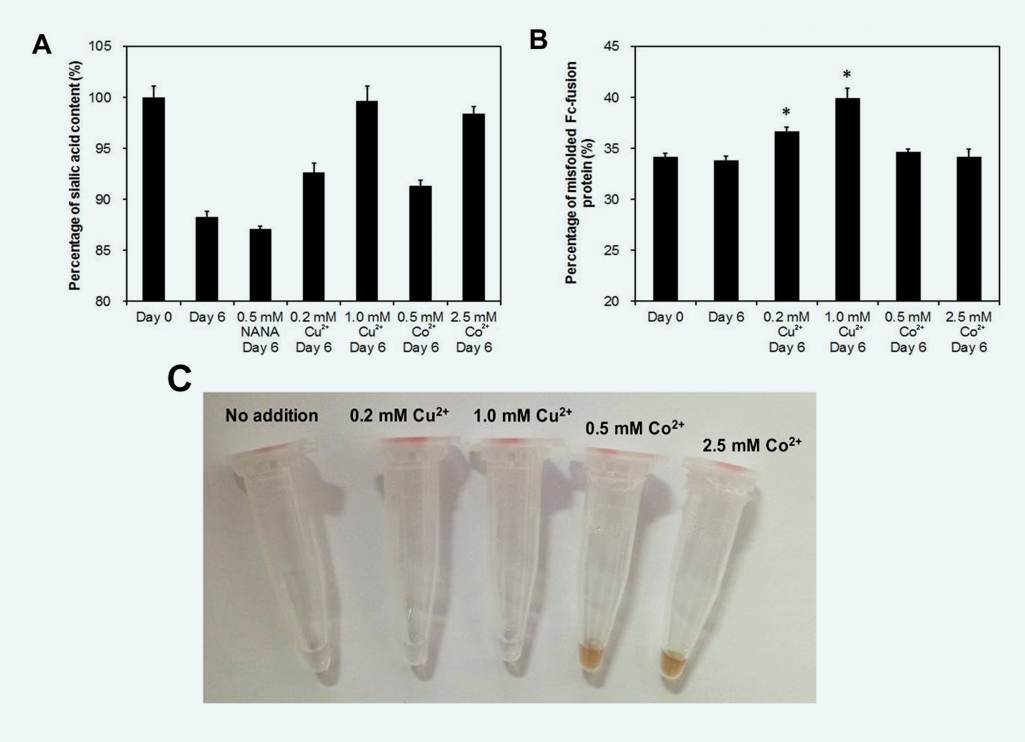
Fig. 4. Effect of NANA and divalent metal ion addition on (A) sialic acid degradation,(B) misfolded form1 and (C) protein color2 of the Fc-fusion protein after cell free incubation. Sialic acid content was normalized to the initial sialic acid content in the cell-free experiment. *p<0.05 relative to the initial status before incubation (n=3). 1, Misfolded Fc-fusion protein was analysed by HIC-HPLC. 2, Samples were treated for 5 mins at 100 °C to denature the Fc-fusion protein.

温度
为了研究温度对唾液酸降解的影响,在四种常用温度下进行了Cell free实验,结果如图所示(图第5A段)。唾液酸在35 °C和37 °C下的前24小时水解率分别为5.47±0.49%和5.29±0.46%,在29 °C 时为4.18±0.08%,32 °C时为3.88±0.37%。在延长的孵育过程中,35 °C和37 °C下的降解速率迅速下降,在低温条件下(29 °C和32 °C)降解速率变慢(图第5A段)。最后,在低温条件下,唾液酸的总降解率在29 °C下为11.52±0.47%,在32 °C时为10.77±0.50%,相比之下,35 °C下和37 °C下培养后的降解率分别为8.69±0.53%和8.33±0.49%。还检测到唾液酸化的N-聚糖,如表1所示。从29 °C到37 °C,培养后发现单唾液酸化和二唾液酸化组分减少。总之,细胞外唾液酸酶活性在轻度低温条件下比在35 °C和37 °C下更低,但更稳定,导致在轻度低温下Cell free培养过程中唾液酸降解更多。
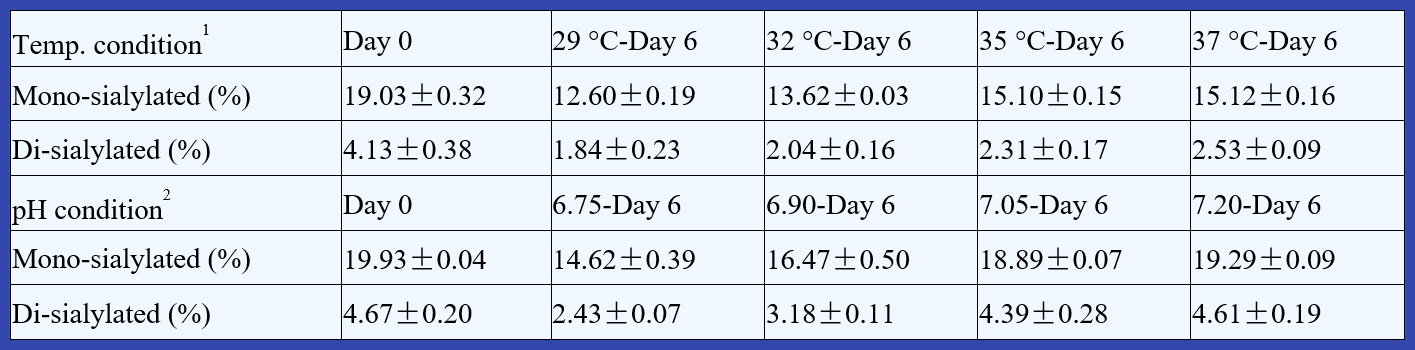
1.The incubation pH was 6.75 in the temperature-gradient cell-free experiments.
2.The incubation temperature was 29 °C in the pH-gradient cell-free experiments.
pH
使用CHO细胞培养过程中四种常用pH条件组成的Cell free实验来了解环境pH与唾液酸降解之间的关系。通过直接向CCS中加入NaHCO3或HCl来实现pH梯度,并且使用NaHCO3-CO2缓冲系统在培养的6天内pH值是恒定的。如图6所示,如图5B所示,CCS中的唾液酸降解受到pH升高的抑制,并且在pH=7.05(2.67±0.16%)和7.20(1.41±0.32%)时观察到唾液酸降解水平非常低。相比之下,在pH6.90和6.75时7.42±0.18%和10.22±0.20%唾液酸被水解。
对于唾液酸化的N-聚糖,在升高的pH下孵育后,单唾液酸化和二唾液酸化的N聚糖的量减少较小(表1)。这些结果表明,在pH超过7.05的CCS中,可以显著防止细胞外唾液酸降解。
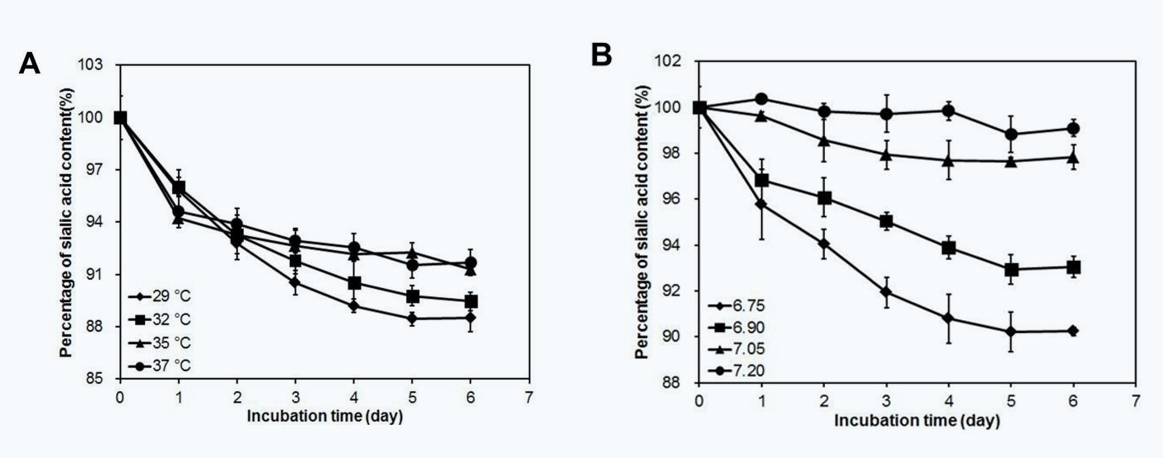
Fig. 5. Time course of sialic acid content level of the Fc-fusion protein during cell-free incubation under different (A) temperature and (B) pH conditions (n=3). Data were normalized to the initial sialic acid content in the cell-free experiment.

▊▊ 通过工艺控制减少唾液酸的降解
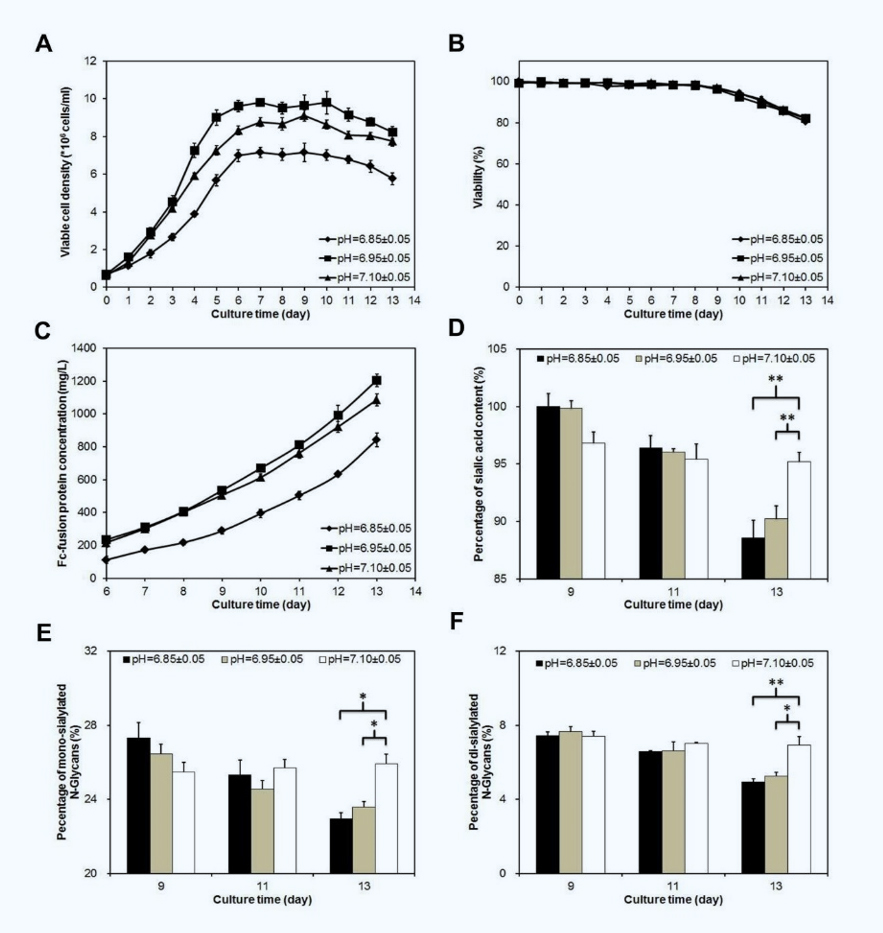
对工艺参数进行研究和调整,以调节细胞生长、代谢和蛋白质量属性。为了证实细胞培养过程中pH对蛋白质唾液酸化的影响,在生物反应器中应用了三种不同的pH设置(6.85、6.95和7.10)。在pH值为6.85±0.05时,细胞生长显著下降,最大活细胞密度为7.16±0.48×106个cells/ml,而在pH为6.95±0.05时为9.81±0.60×106个cells/ml,在pH为7.10±0.05时则为9.12±0.29×106个cells/ml(图6A)。当培养过程中,活细胞密度保持约三天(第6天至第9天),然后活力持续下降至D13培养结束(图第6B段),最终细胞活率分别为80.46±0.93%(pH=6.85±0.05)、82.01±1.72%(pH=6.95±0.05%)和82.34±0.83%(pH=7.10±0.05)。从培养第9天开始,当细胞活力开始下降时,监测唾液酸含量和N-聚糖谱。如图6D所示,唾液酸含量在pH为7.10±0.05条件下几乎保持不变,最终在第13天达到95.17±0.83%。

相反,在其他两种条件下,唾液酸含量从第9天的100.00±1.14%显著降低到第13天的88.57±1.53%(pH为6.85±0.05)和从第9天99.83±0.67%到第13天90.23±1.13%(pH值为6.95±0.05)。IEF-PAGE结果显示:更多的唾液酸导致碱性电荷蛋白质组分减少,在pH为6.85±0.05和6.95±0.05的培养过程中产生了更多的碱性电荷蛋白质。相比之下,电荷分布在pH 7.10±0.05时几乎保持恒定,这反映了培养后期唾液酸含量的稳定性。对于唾液酸化的N-聚糖,从第9天到第13天,单唾液酸化和二唾液酸化组分在7.10±0.05的pH下几乎没有变化,这反映了观察到的唾液酸含量的稳定性,并且它们在其他两种条件下不断降低(图6E和F)。最后,在pH为7.10±0.05时,单唾液酸化和二唾液酸化N-聚糖的百分比分别为25.92±0.43%和6.92±0.37%,显著高于pH为6.85±0.05时的22.94±0.45%和4.93±0.27%以及pH为6.95±0.05的23.57%±0.31%和5.20%±0.23%。此外,在三种pH条件下,对Fc融合蛋白的聚集、错误折叠形式的百分比和断裂的影响最小(表2)。这些数据表明,在较高的pH条件下,CCS中的唾液酸降解大多受到抑制,这些结果可用于防止细胞培养过程中唾液酸含量的降低。
Fig. 6. Profile of (A) viable cell density, (B) viability, (C) Fc-fusion protein titer, (D) sialic acid content level, (E) mono-sialylated N-glycans and (F) di-sialylated N-glycans in the Fc-fusion protein during fed-batch bioreactor culture with different pH levels. *p<0.05, **p<0.01 relative to pH=7.10±0.05 (n=3). Sialic acid content data were normalized to day 3 of pH=6.85±0.05.

Table2 Effect of different bioreactor pH control on other critical quality attributes of the Fc-fusion protein

1. Misfolded form was analysed by HIC-HPLC.
2. Aggregation was analysed by SEC-HPLC.
3. Fragmentation was analysed by non-reduced CE-SDS. N.D: not detected.
▊▊ 讨论
在pH梯度Cell free实验中,发现在pH值超过7.05时,CCS中的细胞外唾液酸酶活性受到显著抑制。作为一个关键的工艺参数,考虑到细胞性能和产品质量属性,pH值始终调整在6.8至7.2的范围内。通过生物反应器实验,证明在CHO细胞Fed-batch培养的后期,将pH控制在7.05以上对于保持产物唾液酸化稳定是可行的。在培养结束时,细胞活力、蛋白质生产或其他质量属性与pH值在6.90和7.10之间没有显著差异。但与6.90的pH相比,将外部pH升高至7.10和7.20降低了Epo-Fc过程中的唾液酸含量,并且在培养的后期,更高水平的唾液酸酶被释放到CCS中,并且CCS的环境更加复杂。细胞外唾液酸酶对产物唾液酸化的影响似乎是一个不可忽视的问题,它决定了糖蛋白的最终唾液酸含量。这项研究结果表明,将pH控制在更高的值是一种有效的策略,可以应用于高密度的细胞培养过程中,以抑制产物唾液酸的降解,并为CHO细胞生物过程的设计提供更多信息,以获得更好的蛋白质质量。

▊▊ References
[1] B, Louise Royle A , et al. "HPLC-based analysis of serum N-glycans on a 96-well plate platform with dedicated database software." Analytical Biochemistry 376. 1(2008):1-12.
[2] Rouiller, Y. , et al. "Effect of hydrocortisone on the production and glycosylation of an Fc-fusion protein in CHO cell cultures." Biotechnol Prog 28.3(2012):803-813.
[3] Qian, Y. , et al. "LongR3 enhances Fc-fusion protein N-linked glycosylation while improving protein productivity in an industrial CHO cell line." Process Biochemistry 53.FEB.(2016):201-209.
[4] Kou, T. C. , et al. "Process analysis of reduced specific productivity of TNFR-Fc in Chinese hamster ovary cells at high cell density." Process Biochemistry 46.7(2011):1492-1499.
[5] Chen, X. , et al. "Characterization and minimization of sialic acid degradation in an Fc-fusion protein-producing CHO cell bioprocess." Process Biochemistry 73(2018).