
生物制品作为现代医药领域的重要组成部分,对于治疗疾病和保障公共健康发挥着重要作用。近几年生物制品行业蓬勃发展,生物制品的种类很多,常见的有疫苗、血液制品、抗体药物、重组蛋白等等,还有以PD-1、PD-L1为代表的免疫检查抑制剂和以CAR-T为代表的细胞治疗已经成为火热的研究领域,随着新冠疫情的爆发,同时也衍生了一大波疫苗的研发浪潮。

然而,在生物制品的生产过程中,各国药审部门对于生物药品中热原物质的含量都有严格控制要求,因为热源的存在会对产品的质量和安全性产生巨大的影响,生产过程中,即使微小的细菌污染也可能引入内毒素,即便起始样品本身不含内毒素也可能由环境或操作过程受到热原污染,从而影响产品质量和产品安全,而较主要的热原就是内毒素(Endotoxin)。所以在生物制品的生产过程中,采取有效的内毒素控制策略是非常重要的。

对于酵母表达系统或CHO (中国仓鼠卵巢细胞系)系统等,虽然表达系统本身不产生内毒素,但在生产过程中因原、辅材料,生产环境以及个人操作等因素造成产品内毒素污染,这是产生内毒素的主要来源。

要从生物产品中去除内毒素,首先需要进一步了解内毒素的性质。内毒素是指具有相关毒性的细菌细胞成分。具体来说高纯度内毒素属脂多糖类(Lipopolysaccharide简称 LPS),来源于革兰氏阴性细菌外膜,是细菌死亡或分解后被释放出来的(图1)。其成分主要含三个不同的化学区:包括内层的类脂 A 区(Lipid A)——引起热原反应、核心多糖区(Core polysaccharide)和特异性多糖链区(repeating oligosaccharides)(图2)。由于内层和中层含许多磷酸基和酸基,所以内毒素带负电荷。
经研究发现,内毒素一端的特异性多糖区是亲水性质的,而另一端的类脂 A 区则是疏水性质的,结构上类似表面活性剂,所以也是具有一定的疏水性质。内毒素一般以聚体形式存在,在亲水环境中还可形成双层脂膜或脂囊。内毒素的磷酸基团和二价金属离子螯合,可进一步稳定内毒素分子间的聚合,促成更大的内毒素复合体,所以分子量可由几千至数千万不等。所以根据内毒素分子具有带负电荷和疏水性特点,使其可以结合带正电荷和疏水性的分子。

内毒素不是蛋白质,因此非常耐热。在100 ℃的高温下加热1小时也不会被破坏,只有在160 ℃的温度下加热2-4个小时,或用强碱、强酸或强氧化剂加温煮沸30分钟以上才能破坏它的生物活性。
内毒素是生物制品中最主要的热原污染,目的样品中极微量内毒素进入人体就会引起高热、腹泻、血管扩张,甚至昏厥或死亡。由于内毒素显著的危害性,FDA等法规也对内毒素控制和将其降低到安全水平提出明确要求。
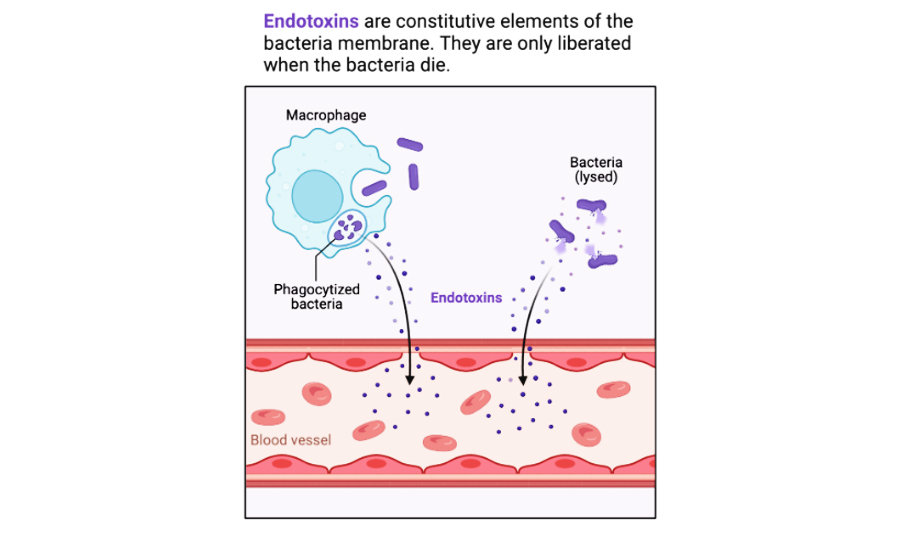
图1 转载自BioRender.com(2021)的“外毒素与内毒素”。
从检索 https://app.biorender.com/biorender-templates.
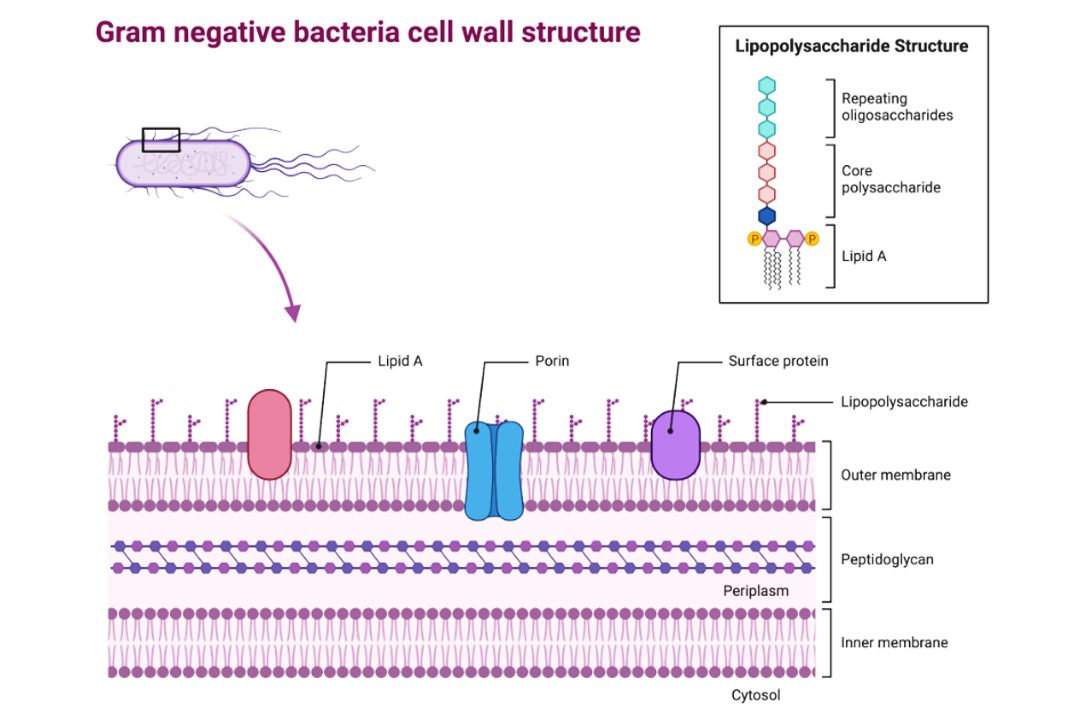
图2 转载自BioRender.com(2021)的“革兰氏阴性菌细胞壁结构”。
从检索 https://app.biorender.com/biorender-templates.
革兰氏阴性菌的包膜由内膜、质周肽聚糖层和外膜组成。内毒素脂多糖(LPS)是革兰氏阴性菌外膜外叶的主要成分(Sampath 2018)。

因生物制品和传统药物有很大不同,生产过程中对微生物的控制策略也不同。为了综合控制生产过程中的内毒素,需要在不同阶段采取相应的控制策略。
✔ 原材料的严格筛选和管理
✔ 生产环境的管理和清洁措施
✔ 生物过程的优化和监测
✔ 细胞系的选择和工程
✔ 纯化和分离工艺的优化
✔ 最终产品的测试和验证
✔ 系统性的风险评估和管理


内毒素控制是生物制品生产过程中的关键环节,直接关系到产品的质量和安全性。通过原材料的严格筛选、生产环境的管理、生物过程的优化、细胞系的选择和工程、纯化工艺的优化以及最终产品的测试和验证,可以综合控制内毒素的风险。







