
培养温度的改变会影响到细胞内一系列与蛋白质合成和分泌相关的基因表达水平。这种影响很大程度上取决于最终降温温度和降温时间。目前降温工艺在中国仓鼠卵巢(CHO)细胞生产蛋白的工艺中被频繁采用,目的是提高产量,控制质量属性。

在本研究中,根据抗体的产量和质量属性以及细胞本身的生长情况评估降温工艺对两种CHO GS K1细胞株产生的影响。研究表明合适的降温工艺对细胞株A单克隆抗体mAb1表达具有显著提升并且工艺可放大到5 L、1,000 L规模,最终mAb1滴度相比未降温的对照组提高了25%。在细胞株B对抗体mAb2的表达中,降温工艺并未引起最终产量的显著提高。除了影响蛋白产量,研究发现降温工艺对包括电荷异质性,N糖基化和分子大小变异体在内的蛋白质量属性有显著影响。
▇▇ 通过摇瓶与2 L反应器实验确定细胞株A的最佳降温工艺
为确定降温对mAb1产量的影响,在摇瓶实验中,设置了32℃,33.5℃和35℃三种常见的降温水平。降温时间分别在3、6、9天进行,以贯穿生产过程中细胞不同的生长阶段,包括早期指数生长阶段,细胞密度峰值阶段和晚期生产阶段。实验表明,与37℃培养的对照组相比,温度在第6天降至32℃的实验组的mAb1滴度从1.20提高至1.31(图1a;p<0.0001)。在第3和第6天降温至32℃的实验组的10-14天单位蛋白产率(图1b)显著高于未降温的对照组(分别是1.29和1.33)。在生产晚期第9天降温的实验组无论是滴度还是产率都没有明显变化,而在较早天数(Day3和Day6)进行的小幅度的降温(33.5℃和35℃)会导致滴度和产率的降低(p<0.0001)。由于摇瓶实验中最高产率出现在设计实验的边界点,所以2 L反应器中的温度设置以32℃为中心进行小幅度转换,降温时间设置在第3,、4、5、6天。实验证实了在第5天将温度降至32℃会得到最高的抗体滴度(图1c)。在所有转换天数中,30.5℃和32℃的产率均高于未降温对照组(图1d)且32℃的最终滴度最高。
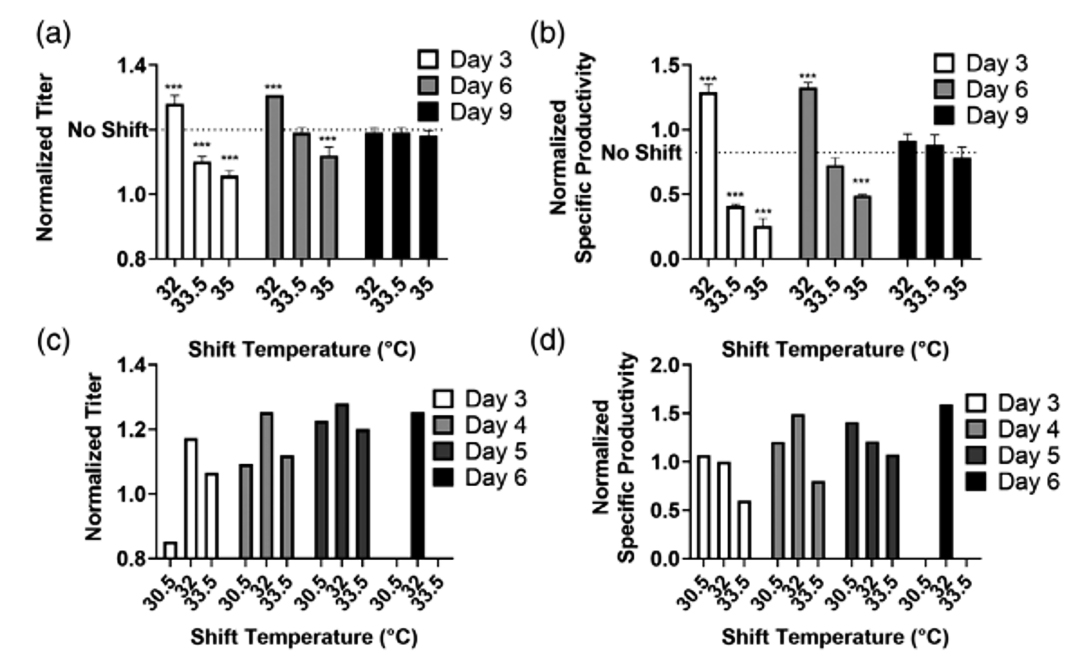
图1 温度转换下摇瓶蛋白滴度(a)和单位产率(b)以及2L反应器中蛋白滴度(c)和单位产率(d)
▇▇ 降温工艺对细胞株A蛋白质质量属性的影响
取样摇瓶和2 L反应器后期样品检测电荷异质性,N糖基化和分子大小变异体。发现降温工艺对蛋白质量属性的影响在摇瓶和2 L反应器中是相似的(图2)。电荷异质性方面,摇瓶实验中主要产物和酸性变体都受到降温工艺的显著影响(p<0.001),降低温度会导致酸性变体含量降低(图2a)。在2 L反应器中,酸性变体含量受到降温工艺的显著影响,温度降低引起酸性变体减少,并伴随着主峰和碱性峰的相应小幅度上升(图2b)。N糖基化在摇瓶实验中相对不受温度转换的影响,不同条件之间的变化的最大范围小于4%(图2c)。2 L反应器实验中,降温仅会导致G0F的轻微增加(图2d)。对于分子大小变异体,摇瓶实验中发现降温引起显著差异,在较低的温度下HMW增加,而不同降温天数对HMW比例无显著影响。温度降低到32℃, HMW比例增加到约对照组的两倍(图2e)。2 L反应器中分子大小变异体在不同降温天数或不同降温温度下均无显著差异,并且HMW比例均在2%左右(图2f)。
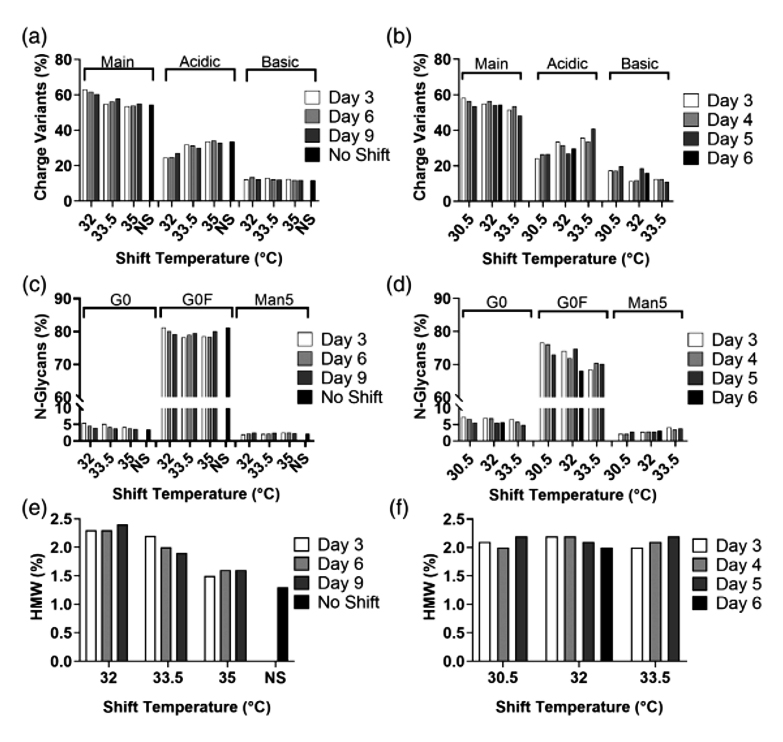
图2 细胞株A质量属性(电荷异质性、N糖基化、分子大小变异体)摇瓶(a,c,e);2 L反应器(b,d,f)
▇▇ 细胞株A在降温工艺优化后的5 L规模和1,000 L大规模生产验证
为了验证降温工艺的可放大性,在5 L反应器中对比了有无降温条件下的生产运行数据,并进一步在降温工艺下进行1,000 L大规模生产验证。
5 L反应器中,对照组与实验组细胞生长曲线整体相似(图3a),只是采用降温工艺后的VCD和细胞活率曲线略高于未降温组(图3a、b)。对照组在VCD峰值后存活率下降至约90%,几天后增加,并在约10天开始再次下降直至最终大约90%;降温实验组细胞保持了95%以上的活率。VCD在峰值后持续下降,而活率仍然很高,这表明不健康细胞完全裂解。值得注意的是,降温在第5天发生而蛋白滴度的提升直到第10天之后才显现,此时实验组中的抗体浓度明显大于对照组(图 3c)。实验组的最终mAb1蛋白滴度比对照组高约25%。降温后,葡萄糖的消耗量显著降低(数据未显示),但乳酸含量没有受到显著影响(图3d)。降温后氧气通量显著降低(图3e)以保持40%溶氧设定。pCO2随温度变化略有增加,但是到生产结束时,两条件之间没有显著差异(图3f)。
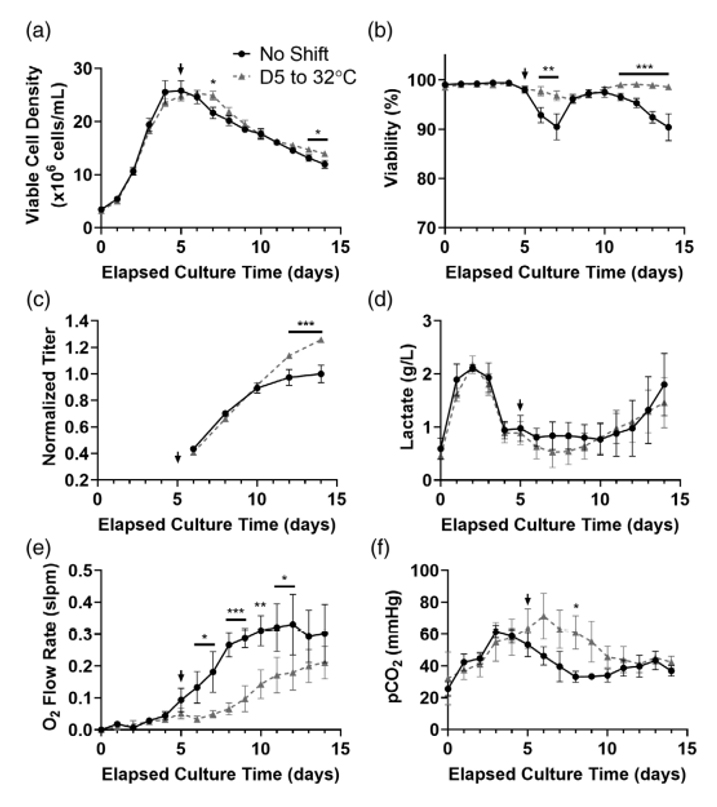
图3 5 L反应器中降温(Day5,32℃)与未降温的生产运行数据(a)VCD(b)活率(c)滴度(f)乳酸浓度(e)氧通量(f)CO2分压
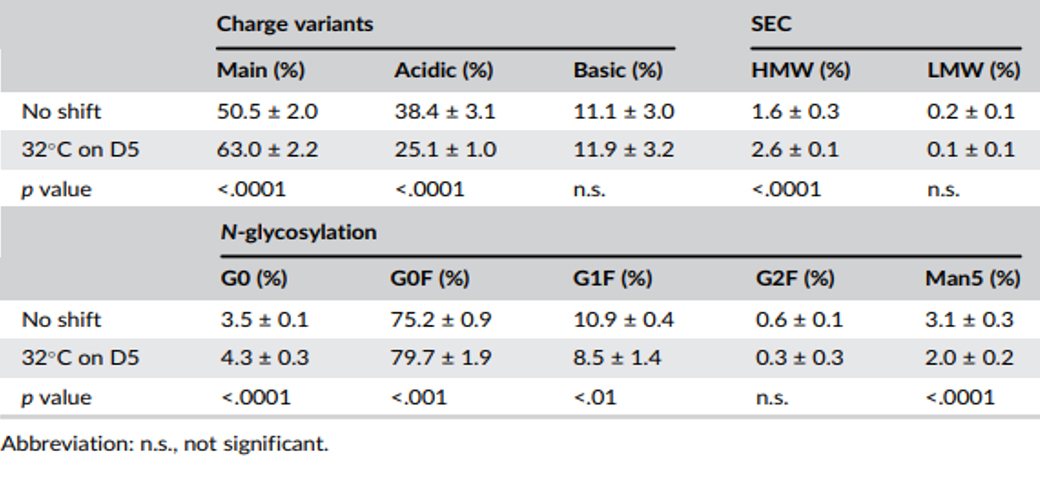
表1 5 L反应器蛋白质量属性对比
5 L反应器中的蛋白质质量属性与先前筛选实验的相似。对于电荷异质性,mAb1的主峰和酸性峰受到的影响最大(表1)。主峰增加了约△13%,而酸性变体则相应减少,碱性峰无显著变化。大多数N糖基化种类具有显著统计学差异。然而,观察到的最大差异是G0F变化小于△5%,这不会引发临床问题。G0和Man5比例在降温和未降温条件下差异最显著,在降温工艺下,G0增加约△0.8%,Man5减少约△1.1%。分子大小变异体遵循与初始筛选实验类似的趋势,HMW含量从1.6%增加到2.6%,增幅较小,下游纯化能够去除。
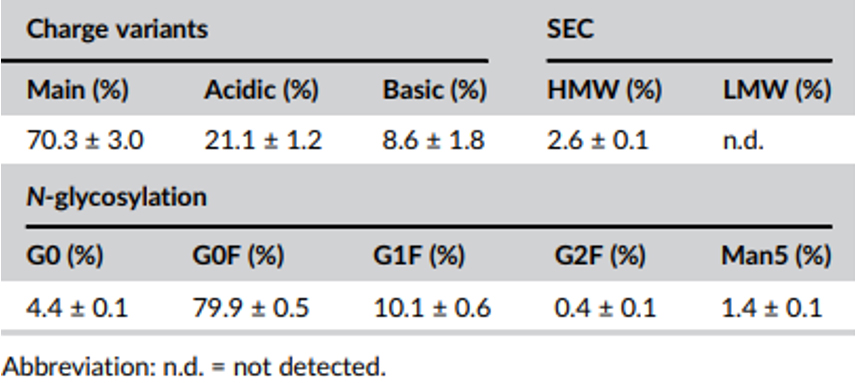
表2 1,000 L反应器抗体质量属性
在1,000 L临床生产规模应用此前的降温工艺。VCD 曲线和细胞活率与 5 L 生物反应器规模相似,第 5 天左右达到峰值 VCD 约为 25E6 /mL,最终活率大于 95%(图 4)。降温工艺引起的最终滴度的提高也可从5 L规模转移至1,000 L生物反应器规模,相对于对照组,滴度增加了约25%。分析蛋白质量属性发现所有质量指标都与5 L反应器有类似的趋势。相对于降温工艺下5 L生物反应器中酸性峰和主峰的含量分别为25.1±1.0%和63 ± 2.2%,1,000 L中酸峰为21.1 ± 1.2%,主峰相应增加到70.3 ±3.0%(表2)。
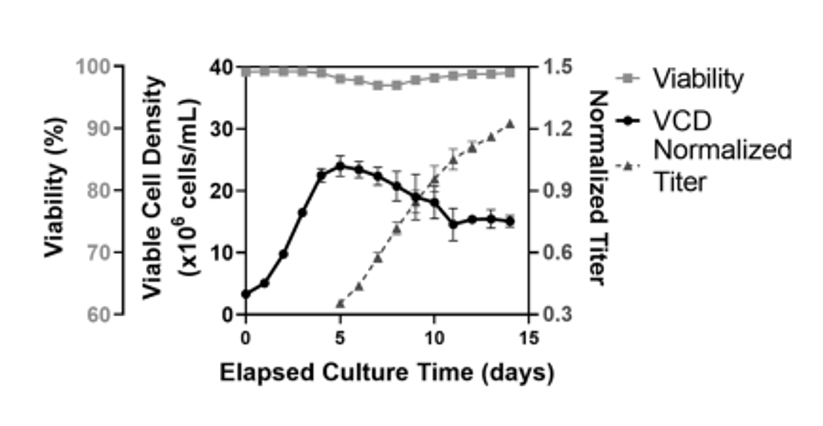
图4 1,000 L反应器生产运行数据
▇▇ 降温工艺对于细胞株B产量和质量属性的影响
对同属CHO GS K1细胞系的细胞株B进行了类似的全因子降温工艺筛查。在第3天或第6天,将温度从36.5℃降低到30℃,32℃或34℃,并与未降温的对照组进行比较。
细胞株B的生长曲线显示,在第3天的指数生长期进行降温,所有转换温度下的VCD值均明显降低(图5a)。在第6天进行转换,三种温度下的实验组均可达到与对照组相近的的VCD峰值,并在此后的培养中保持略高的VCD。与细胞株A类似,相对于对照组,在任一降温工艺条件下的细胞株B的活率在生产后期中都保持在更高的水平(图5b)。就抗体滴度而言,除了在第6天降温至34℃的产量不显著低于对照组,其他降温的实验组最终滴度都受到显著负面影响。与对照相比,降温至30℃和32℃均使抗体单位产率降低,而小幅降至34℃没有显著影响。活细胞密度积分(IVCD)显示出与VCD图谱相似的趋势,即第3天降温的实验组IVCD低于对照组而在第6天降温的实验组IVCD略高于对照组(图5e)。
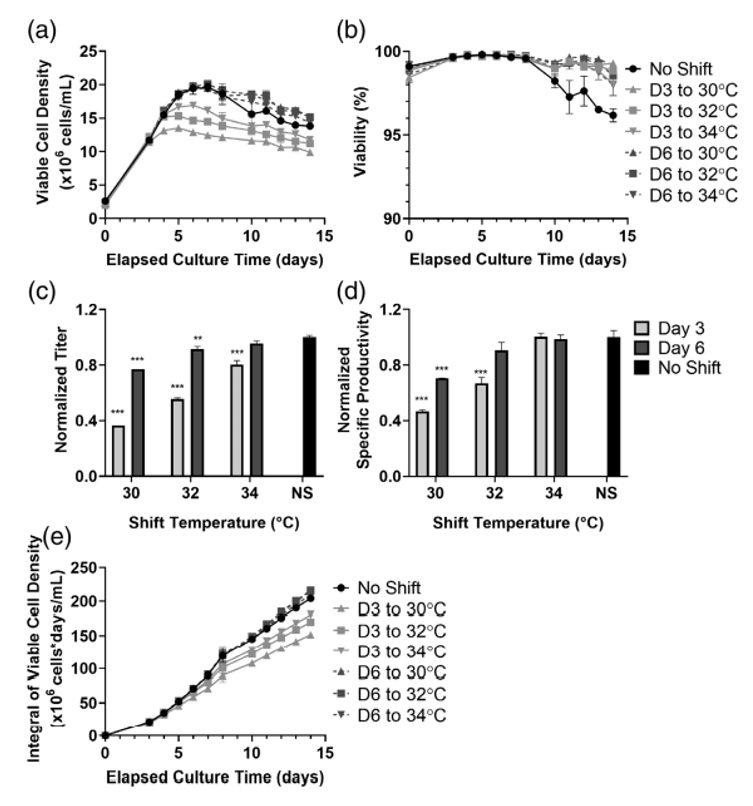
图5 有无温度转换细胞株B的生长情况及抗体产量
分析产物的mAb2质量属性。对于电荷异质性,降温工艺会对mAb2的电荷变量分布产生显著影响(图6a)。温度降低更多,或降温时间提前,酸性峰显著减少,碱性峰增加。电荷变量变化的最终结果是,主要产物在小幅度降温条件下最高(第6天降至34℃),而在降温较多或降温较早的条件下(第3天为32和30℃)显著削减。N糖基化仅受第3天早期温度变化的显著影响(图6b)。通过多变量方差分析,最终降温不是一个显著因素。在细胞系B中,降温工艺不会影响分子大小变异体的比例,无论是实验组还是对照组,HMW含量都小于1%(图6c)。
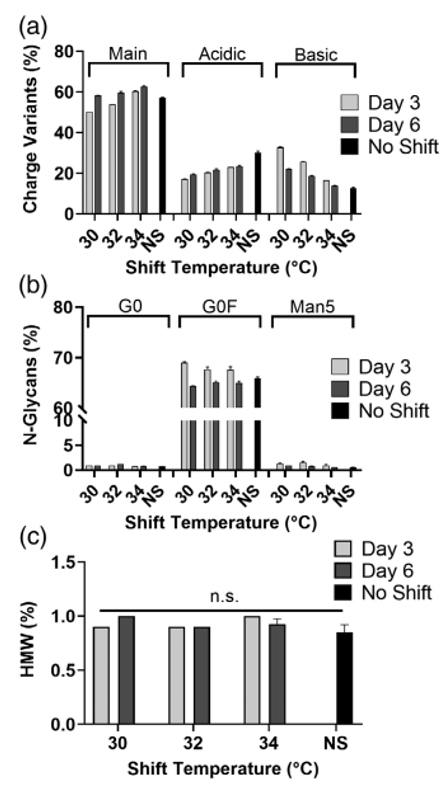
图6 细胞株B的质量属性(a)电荷异质性(b)N糖基化(c)分子大小变异体
▇▇ 讨论

许多研究表明,可以通过降温减少酸性电荷变量。本研究也表明,尽管对这两种细胞株产量的影响不同,但 mAb1 和 mAb2 的酸性电荷变量随着温度的降低而显著降低(图 2a、b 和 6a)。据推测,降温条件下蛋白质酸性变体的减少是由减慢的降解动力学或提高的细胞活率引起的,这可以防止可能损坏最终产物的降解酶的释放。细胞株 B 的 mAb2 主峰增加而最终滴度没有增加,这表明降温工艺可能在蛋白质生产过程中主要起提高质量而不提高产率的作用。两种细胞系之间的降温时间的影响也不同。在两个筛选实验中,降温时间都不对mAb1 电荷异构体产生显著影响(图 2a、b)。对于细胞株B,第3天降温比第6天降温对碱性峰有更强的影响(图 6a),这可能与细胞系 B 早期降温造成的细胞生长抑制有关(图 5a、e)。低温下细胞系 B 的 mAb2 碱性峰增加可能是由于羧肽酶表达降低,导致的C 末端赖氨酸不完全裂解。总而言之,降温对电荷变量的影响主要是由降低温度的多少驱动的,而不是降温时间。

其他蛋白质质量属性,包括 N糖基化和分子大小变异体,都受到降温工艺的影响,并且两种细胞系之间的影响也不同。mAb1 的 N糖基化相对不受降温工艺的影响。mAb1 的实验组与对照组之间最显著的差异是 G0 和 Man5 的变化,包括大约 △1% 的差异和半乳糖基化的轻微降低。mAb2 的糖基化受到早期第 3 天降温的显著影响,这导致半乳糖基化减少类似于 mAb1,G1F 和 G2F 分别减少 &△5% 和 &△0.8%,G0F 相应增加 &△3%(图 6b)。关于分子大小变异体,mAb1的HMW比例在较低降温下而增加了约两倍(图 2e、f),但相对于对照组,所有降温工艺下的mAb2 的 HMW 比例没有显著变化(图 6c)。mab2的LMW在所有条件下均不受降温工艺的影响,并且在所有测试条件下两种细胞系的 LMW 均低于 1%。降温工艺对 mAb1 和 mAb2 之间聚集的不同影响不足为奇,因为一些文献报告称在降温工艺下聚集体增加,有些聚集体减少,或两者都有,具体取决于其他工艺参数。降低培养温度可能增加或减少聚集的确切机制很复杂,不容易归因于任何单一原因。

降温工艺可以从多方面促进蛋白质的生产。本研究成功将摇瓶筛选实验中确定的降温条件放大至5 L反应器规模(图 1、3)并扩大到 1,000 L生产规模,同时在 mAb1 生产率和蛋白质质量方面取得了类似的改进(图 4 和表 2)。降温工艺的一个常见好处是提高某些细胞系的生产力和最终滴度,本研究中细胞系 A 的最终 mAb1 滴度提高了 25% 以上(图 3c)。尽管 mAb2 的滴度没有随着温度变化而提高(图 5c),降温工艺却可能有助于控制蛋白质量(图 6a)。在这两种细胞系中,最终细胞活率在所有降温工艺下都保持更高水平。这可能使得死亡和膜受损细胞释放的宿主细胞蛋白种类减少,被蛋白酶降解的可能性降低,从而减轻下游纯化的负担。研究发现,降温后细胞株 A 的单位葡萄糖摄取率降低而乳酸曲线与对照组(图 3d)没有显著差异,抗体滴度增加可以推测出:随着温度变化,细胞株 A 的能量更有效地重新分配到产物形成上去。其次降温工艺减少了氧通量(图 3e),很可能是由于低温下细胞代谢减少和氧气溶解度增加所致。降低氧气流速在大规模生产中尤为重要,可以减少气泡对细胞的切割破坏,反应器起泡和供氧问题。
总之,本研究证明了将降温工艺纳入蛋白生产流程有很多好处,并且即使在没有滴度提高的情况下,温度变化也可能对控制质量属性有帮助。

参考文献:
McHugh KP, Xu J, Aron KL, Borys MC, Li ZJ. Effective temperature shift strategy development and scale confirmation for simultaneous optimization of protein productivity and quality in Chinese hamster ovary cells. Biotechnol Prog. 2020 May;36(3):e2959. doi: 10.1002/btpr.2959. Epub 2020 Jan 17. PMID: 31930722.







