 赋成生物设置专职验证部门,协同生产、质量控制、质量保证、设备工程、计算机化系统、供应链等部门组成专业验证团队,采用基于科学与风险及生命周期原则对设备、设施、系统、方法、工艺进行确认与验证,为保证产品质量、保护患者安全、提高客户满意度、持续保持GMP合规性提供有力保障,推动大分子新药产业化进程。公司执行的验证活动见图1.
赋成生物设置专职验证部门,协同生产、质量控制、质量保证、设备工程、计算机化系统、供应链等部门组成专业验证团队,采用基于科学与风险及生命周期原则对设备、设施、系统、方法、工艺进行确认与验证,为保证产品质量、保护患者安全、提高客户满意度、持续保持GMP合规性提供有力保障,推动大分子新药产业化进程。公司执行的验证活动见图1.
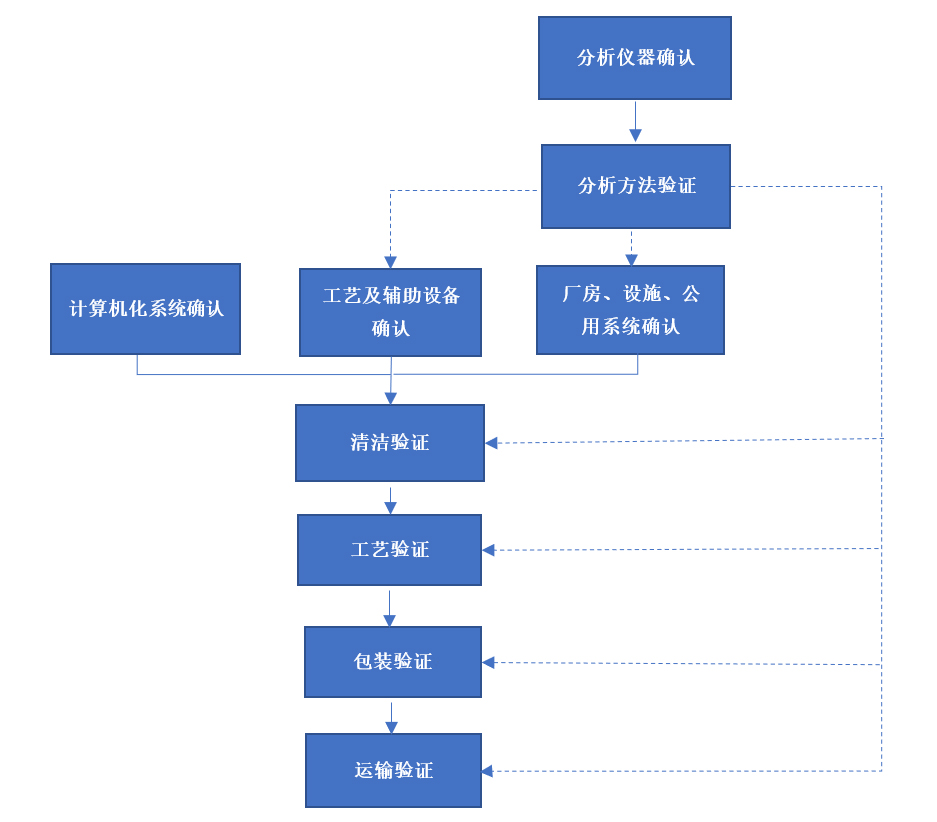
图1 验证活动执行流程概览
01. 规范、高效、可靠的验证管理系统
▶ 规范化层级管理的验证文件(图2):通过工厂验证总计划(VMP)总体确定需要进行的确认与验证活动,按照需求制定特定项目验证总计划、分别起草详细的验证方案、按照方案实施测试、形成原始记录并起草验证报告,特定验证计划实施完成后根据各个验证报告形成验证总结报告。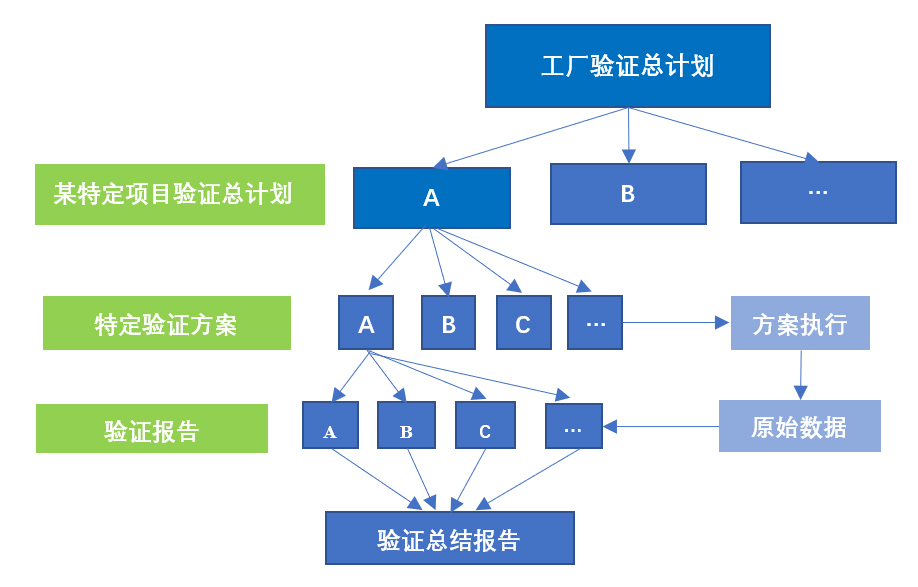
图2 验证文件层级示意图
▶ 验证文件的审批、生效,方案的培训、验证记录/报告归档使用经验证的iGMP管理系统,使验证活动更加高效、合规并保证验证数据的可靠性
02. 质量风险管理贯穿厂房设施设备的确认
▶ 以质量风险管理的方法贯穿整个设施设备的生命周期,对设备进行系统影响性分类评估,按照USP 1058对分析仪器进行分类评估,对直接影响系统、B类/C类分析仪器进行确认,采用FMEA等工具进行验证风险评估,确定确认项目;
▶ 参考验证V模型(图3)进行设施设备、系统的确认活动(举例见图4),响应风险分析的结果,使用户需求、法规要求、风险降低的需求都在验证活动中获得确认。
▶ 对经过验证的设施设备进行定期回顾和/或再验证,确保处于持续的验证状态。
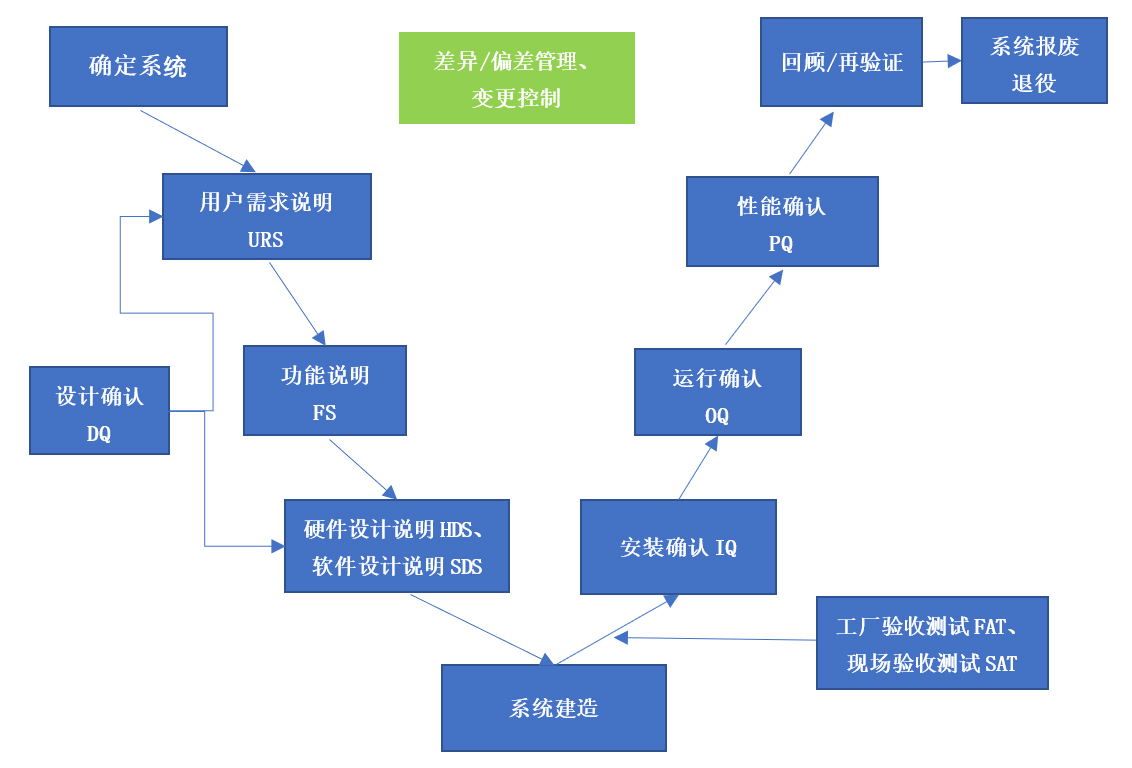
图3 验证V模型-系统验证生命周期流程图

图4 厂房设施设备确认举例
03. 计算机化系统验证
▶ 对GxP关键的计算机化系统,进行软硬件分类评估、数据管理分类评估、21 CFR Part11电子记录和电子签名适用性评估。基于以上初步评估确定生命周期活动,并通过功能性风险评估确定验证程度。
▶ 对经过验证的计算机化系统实施定期回顾,确保系统处于持续的验证状态。
04. 分析方法确认
▶ 参考USP 1220分析方法生命周期原则对分析方法实施设计开发、方法性能确认、持续方法确认三个阶段管理(图5),从应用科学和质量风险管理中获得知识,并利用其改进和保证数据质量,从而更好地使方法所有阶段均可获得持续有效改进,保证方法的准确可靠。

图5 分析方法生命周期管理图例
▶ 根据分析方法的风险级别采用方法核对、方法确认、方法验证不同深度的验证方式。
▶ 只有经确认或验证的方法方可用于物料、产品检验放行。

图6 仪器分析方法验证举例
05. 清洁验证与清洁确认
▶ 对多产品共线厂房设施设备进行共线风险评估,采取管理措施及清洁验证或清洁确认方式将交叉污染风险降低至可接受水平。
▶ 对重复使用的生产设备接触产品表面进行清洁验证,根据风险评估结果对间接接触产品的重复使用设备进行简化的清洁验证或免除清洁验证。
▶ 在不能获得至少连续3批的清洁验证实施条件时,在产品切换时,采取每批进行清洁确认(举例见图7)的方式,确保残留符合可接受标准。

图7 设备清洁确认举例
06. 基于科学和风险的工艺验证
▶ 按照FDA工艺验证指南分为工艺设计、工艺确认、持续工艺确证三个阶段进行(图8)。随着对工艺理解的持续加深,不断优化控制策略,使工艺验证更加有效。
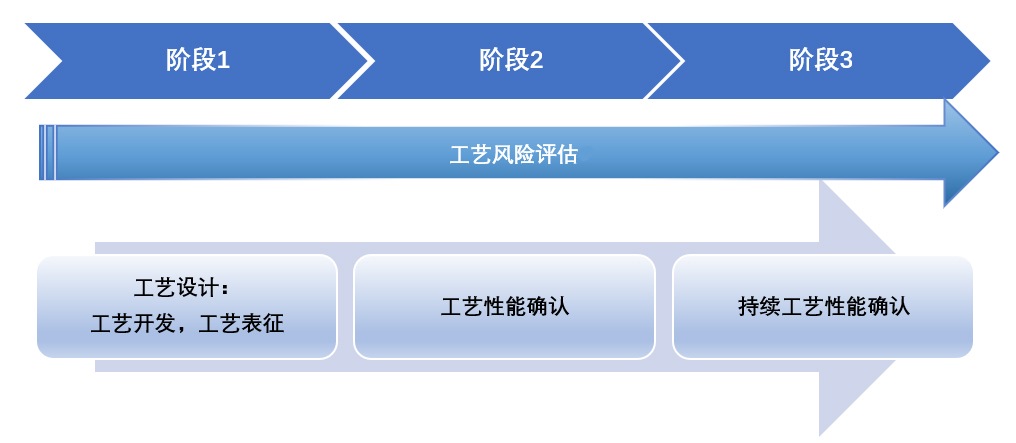
图8 工艺验证生命周期示意图
▶ 对无菌工艺进行周期性(每班每半年1次)培养基模拟灌装验证(图9),以持续监控和评价无菌工艺保障水平。

图9 培养基模拟灌装及培养后检查举例







