
生产管理是药品质量形成的关键环节,是持续稳定输出高质量药品的基础。GMP生产管理相关条款中的落脚点都是防污染、防差错,其中风险管理及过程控制为防污染、差错主要的手段及措施。

本文将重点从生物制药制剂生产工艺特性、无菌制剂生产管理及无菌控制等几个方面来介绍GMP体系下生物制药的制剂生产管理。

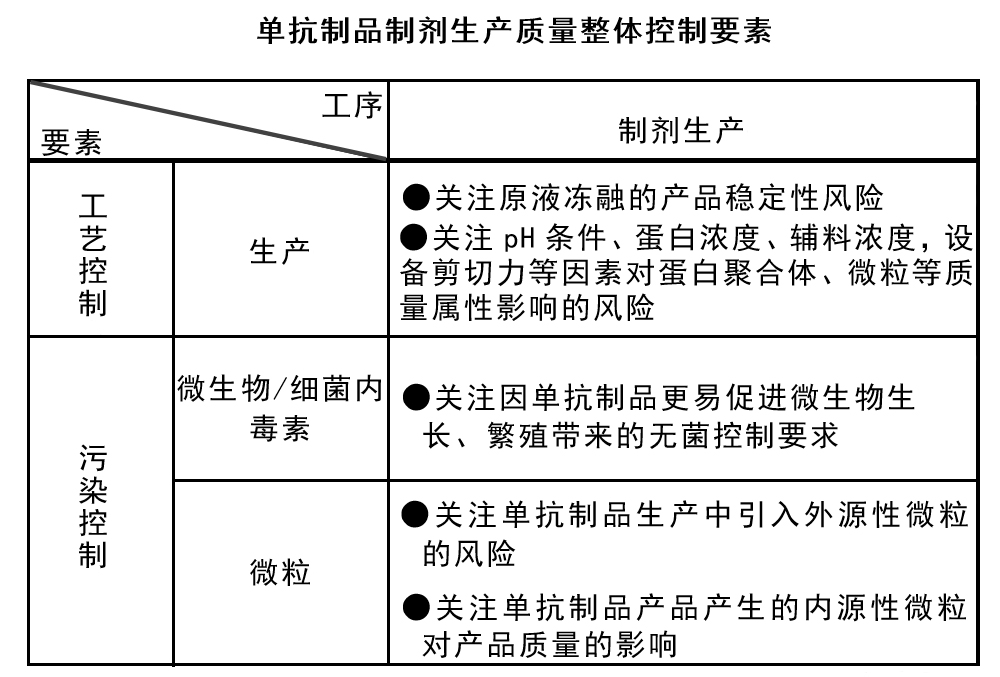
生物制药单抗制品本身的性质复杂,需从产品质量属性出发,基于风险建立健全的工艺控制要求,以稳定、一致地生产出符合安全性、有效性要求的产品。应对每一质量属性进行风险分类或排序,以识别关键质量属性并建立初步的控制要求,通常常规质量属性及污染相关属性在不同项目中均可直接判定为关键质量属性。
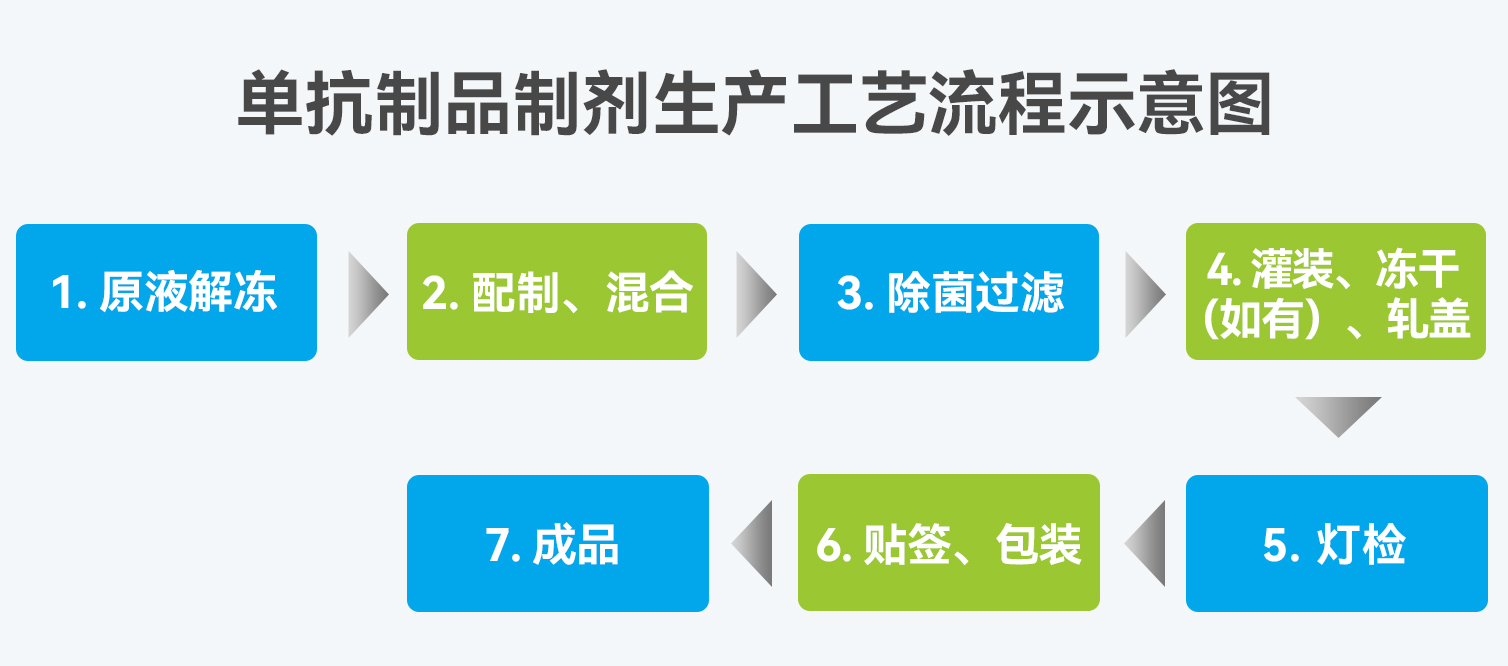
生物制药中制剂生产工艺解冻方式、配液搅拌方式、温度控制、内毒素控制因素等可能影响生物制剂产品质量控制标准及要求,对于制剂生产灌装,因蛋白分子的聚集及剪切力的影响,尽量选用蠕动泵方式进行灌装。生物制品的冻干要求都是要保持产品的活性,因此对冻干工艺要求严格,预冻温度、速率、时间等的控制都很重要。通过优化冻干工艺,生物类制品在冻干过程及保存期间的稳定性同样也能够得到一定的改善。
生物制药一般以无菌制剂水针及冻干制剂为主,与非无菌产品相比,无菌产品的关键质量属性通常还包括无菌、热原/细菌内毒素、微粒等指标,产品的无菌得不到保障或热原/细菌内毒素、微粒超标很可能会对患者带来危害,且无菌检测有一定的局限性,因此,无菌产品的生产管控尤为重要。
各国药品生产质量管理规范(GMP)的提出均涉及一个共同的目标“最大限度地降低药品生产过程中污染、交叉污染以及混淆、差错等风险,确保持续稳定地生产出符合预定用途和注册要求的药品”。而为了满足这一目标,“污染控制措施”是一个核心要素,新CCS的提出,旨在将污染控制向着整体分析的方向转变,避免单独污染控制措施之间的风险疏漏或单独污染控制措施的过度执行,也可有效的推动持续改进和/或改正。


❶ 人是洁净区环境的最大污染源,人员的数量和活动量将直接影响整个洁净区的环境质量。人员因健康问题,如患有传染病、皮肤病、创伤等可能引入微生物污染风险。应当精心设计并建立洁净区人员卫生、行为规范和人员资质确认程序,对人员进行微生物知识、无菌更衣、无菌操作、取样等有关培训。尽可能采用物理屏障手段,减少人员手工操作步骤,最大限度地降低人员对药品生产造成污染的风险。
❷ 设备表面也是可能的污染源,应明确设备的清洁和消毒方式(手工或在线)并制定书面的清洁消毒规程,规定每一台设备的清洁消毒程序,明确清洁和消毒使用的清洁剂和消毒剂以及清洁消毒周期。生产设备或系统应尽可能采用密闭系统,其构设计、组装、清洁消毒和存放均应考虑降低生物膜形成的风险。
❸ 单抗制品原材料及辅料特殊关注点主要包括:动物源性物料风险、工艺特殊添加物去除能力、微生物(细菌、真菌)/支原体/病毒及细菌内毒素污染风险等。单抗生产用耗材特殊关注点主要包括:工艺匹配性、相容性、外来污染控制、完整性控制等。
❹ 工艺规程和岗位操作法是企业生产技术管理的基础,是组织与指导生产的主要依据,因此必须认真编制并严格执行工艺规程和岗位操作规程。按照批准的工艺规程和标准操作规程进行操作,确保生产的持续稳定。
❺ 厂房密封性不够、车间布局不合理、厂房清洁消毒不彻底都可能引起微生物对环境的污染,进而造成污染产品的风险。应从设计上考虑对微生物污染的防控,例如:人物流的合理划分,车间功能间的合理布局,洁净区空调系统、压差、水系统、气体等公用介质系统的设计,建立厂房设施的清洁消毒要求,对消毒剂效力进行验证等。


生物制剂制药生产的工艺工程系统,涉及到人、机、料、法、环等很多环节。任何一个环节的疏忽,都有可能会影响到药品的质量。因此严格按照GMP的要求至关重要,不仅制定和执行相关的规章制度及措施以保证药品的质量,还运用质量源于设计的理念,系统的识别出所有生产关键方面并遵循同样的原则进行管理,从而实现高质量药品的稳定持续制造。

赋成生物制剂生产平台配有先进的进口及国产隔离器生产线,配置一次性配液灌装系统,能够满足2R、6R、10R、20R等不同规格产品的水针或冻干产品生产,欢迎各位垂询。







